Demenza di Alzheimer e il nuovo farmaco Donanemab (Kisunla)
23 Luglio 2024

Hai bisogno di un parere su questa condizione?

Dott. Pietro Gareri
30 minuti - 70 € 35 anni di esperienza Specialista in Medicina Interna e Geriatria Richiedi una televisita con: Dott. Pietro GareriGarantito in 24 ore! Con questo specialista o un suo collega.
Alzheimer: tutto quello che c’è da sapere e i nuovi farmaci in arrivo
In questo articolo parleremo della demenza di Alzheimer e del nuovo farmaco Donanemab (Kisunla) che sembra rallentarlo.
In medicina, la parola “demenza” è un termine generale per indicare una malattia caratterizzata da deficit cognitivi, di giudizio e/o di memoria.
Le persone affette da una forma di demenza solitamente presentano una più o meno marcata perdita di memoria associata ad un altro deficit.
Tale deficit tende a manifestarsi nel tempo, come la difficoltà a parlare o scrivere in modo coerente, a riconoscere l’ambiente familiare oppure a pianificare e realizzare compiti complessi.
Poiché tutti noi possiamo manifestare anche piccoli deficit in queste aree, soprattutto in periodi di stress, per essere considerati rappresentativi di demenza (e quindi meritevoli di ulteriore investigazione) questi problemi devono essere sufficientemente gravi da interferire con le attività quotidiane.
Sebbene la maggior parte delle persone, come demenza, conosca esclusivamente la malattia di Alzheimer (rappresenta circa il 60% di tutti i casi) esistono diverse altre forme di questa patologia.
Tra e demenze abbiamo: demenza vascolare, demenza a corpi di Lewy, demenza mista (un quadro di tipo Alzheimer associato ad esempio a vasculopatia cerebrale), demenza di Parkinson, demenza fronto-temporale, demenze connesse con danni da alcol, trauma cerebrali, ecc.
Alzheimer, cause, fattori di rischio e caratteristiche
Demenza di Alzheimer
La demenza di Alzheimer è la causa più comune di demenza e si presenta tipicamente con caratteristiche ben precise:
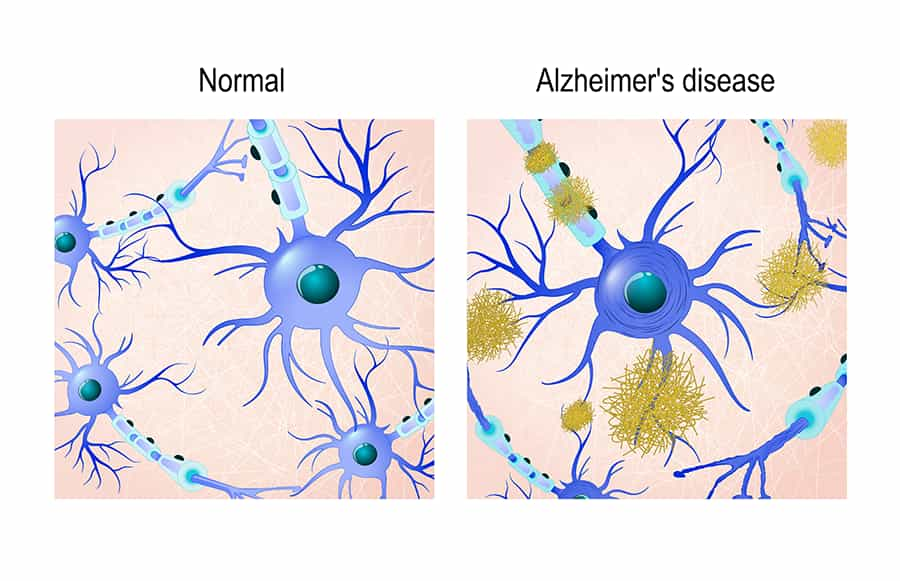
- Placche diffuse nel cervello, caratterizzate da deposizione extracellulare di una sostanza definita beta-amiloide;
- Grovigli neurofibrillari, costituiti dall’accumulo intracellulare di una proteina tau iperfosforilata (p-tau).
Cause scatenanti l’Alzheimer
Esistono diversi fattori chiamati in causa nella genesi o nell’avanzamento della malattia di Alzheimer. Tra queste, le placche amiloidi extracellulari rappresentano un punto cardine.
Composte principalmente da peptidi di beta amiloide, le placche possono essere dovute all’aumento della produzione di una sostanza chiamata proteina beta amiloide, oppure al ridotto metabolismo e alla rimozione della stessa proteina una volta costituitasi in placca.
Un altro fattore rilevante nella genesi dell’Alzheimer è rappresentato dalle patologie che colpiscono i vasi sanguigni cerebrali. Sebbene siano la principale causa delle demenze vascolari, nel caso della malattia di Alzheimer esse contribuiscono all’aumento della deposizione della sostanza amiloide e alla successiva neurodegenerazione.
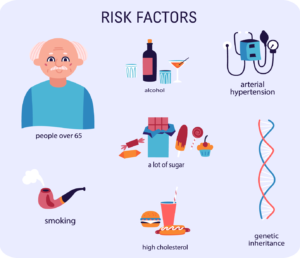
Fattori non modificabili
Se è vero che le patologie vascolari cerebrali possono essere prevenute mantenendo la pressione bassa, riducendo i livelli di colesterolo e adottando altre precauzioni, alcuni fattori implicati nella malattia di Alzheimer non sono modificabili.
Uno di questi è sicuramente l’età, che rappresenta il principale fattore di rischio per la demenza (non solo di Alzheimer).
La demenza diventa infatti molto comune nelle persone sopra gli 80 anni, colpendo in media una persona su sei tra gli 80 e gli 85 anni, una su tre sopra gli 85 anni e quasi una su due oltre i 90 anni.
Altro fattore non modificabile è la familiarità, dato che alcune forme di demenza hanno una componente genetica. Avere un familiare stretto affetto dalla malattia di Alzheimer aumenta le possibilità di svilupparla. In particolare, gli scienziati hanno scoperto un gene, chiamato APOE epsilon 4, che aumenta il rischio di sviluppare la malattia di Alzheimer.
Purtroppo, non si può prevedere chi svilupperà la patologia, in quanto anche tra gli individui portatori di questo gene solo la metà manifesterà la malattia entro i 90 anni.
Ciò suggerisce che siano coinvolti anche altri fattori genetici e ambientali ad oggi non chiari.
Altre cause sono rappresentate da patologie più comuni come l’ipertensione, il diabete o l’abitudine tabagica – il fumare di frequente – che possono contribuire alla malattia. Al contrario l’attività fisica, i rapporti sociali o le attività cognitive sembrano essere protettivi verso la demenza, riducendo la probabilità di sviluppare questa malattia.

Fattori di rischio genetici
Come abbiamo visto, a parte l’età, i fattori di rischio più chiaramente accertati per la malattia di Alzheimer sono la familiarità, le rare mutazioni ereditarie dominanti nei geni che influiscono sull’amiloide nel cervello e, come detto, l’allele epsilon 4 (e4) dell’apolipoproteina E (APOE).
Le basi genetiche di questa patologia sono comprese più chiaramente nella forma a esordio precoce, che però, come detto, rappresenta meno dell’1% dei casi.
L’esordio precoce è correlato a mutazioni nei geni che alterano la produzione, l’aggregazione o l’eliminazione della proteina beta amiloide. Tali mutazioni sono talmente importanti che i portatori hanno una probabilità quasi del 100% di sviluppare la malattia nel corso della loro vita.
La genetica è responsabile anche nel caso di storia familiare di demenza, che è un fattore di rischio per lo sviluppo della malattia di Alzheimer. I pazienti con un parente di primo grado affetto da demenza hanno un rischio aumentato dal 10 al 30% di sviluppare la malattia. Ciò è particolarmente vero se il familiare ha manifestato la malattia già in giovane età.
Fattori di rischio modificabili
Ma la genetica da sola non spiega tutti i casi: una varietà di fattori acquisiti influenzano il rischio di demenza e la sua comparsa. Tra questi dobbiamo considerare il diabete (qui parliamo di diabete e invecchiamento cerebrale), ipertensione, inattività fisica, dislipidemia, (tutte cause anche dell’infarto miocardico) malattie cerebrovascolari, traumi cerebrali, ecc.
Molti di questi fattori di rischio sembrano essere più rilevanti quando si presentano nella quarta o quinta decade di vita dei pazienti. In uno studio, gli individui con due o più fattori di rischio vascolare nella mezza età risultavano avere una probabilità quasi tre volte più alta di creare accumuli di sostanza beta-amiloide nel cervello in più tarda età.
Pertanto, la gestione delle malattie vascolari e degli altri fattori di rischio modificabili rappresenta una strategia chiave per ridurre il rischio, la progressione e la gravità della malattia di Alzheimer e di altre forme di demenza.
Età di esordio
La malattia di Alzheimer è tipicamente una malattia dell’età avanzata. È insolito che la si manifesti prima dei 60-65 anni. L’incidenza e la prevalenza aumentano esponenzialmente con l’età, raddoppiando la prevalenza ogni 5 anni dopo i 65 anni.
Esiste però una forma ad esordio precoce che si verifica in circa il 5% di tutti i pazienti con malattia di Alzheimer. Questi pazienti, in media uno ogni venti, spesso si rivolgono al medico non per amnesia ma a causa di preoccupazioni sulle prestazioni lavorative; presentano sintomi in qualche modo atipici come cambiamenti linguistici, visivi o comportamentali, piuttosto che una vera e propria perdita di memoria.
Anche le forme ereditarie della malattia di Alzheimer si presentano abitualmente prima dei 65 anni di età e frequentemente nella quinta decade, o addirittura prima. Queste forme, fortunatamente, rappresentano meno dell’1% di tutti i casi di malattia di Alzheimer.
In particolare, sono un modello di ereditarietà autosomico dominante correlato a mutazioni nei geni che alterano la produzione o il metabolismo della proteina beta-amiloide (Aβ), inclusa la proteina precursore dell’amiloide (APP), la presenilina-1 (PSEN1) e la presenilina-2 (PSEN2).
In una metanalisi su 1.307 pazienti con malattia di Alzheimer autosomica dominante, l’età media di insorgenza dei sintomi era di 46 anni. L’eta d’insorgenza era altamente correlata all’età d’insorgenza della malattia nei genitori e al tipo di mutazione.
Vi è poi la malattia associata alla sindrome di Down: dovuta alla dose genetica aggiuntiva di APP a seguito della trisomia del cromosoma 21. I sintomi emergono in età precoce, da 10 a 20 anni prima rispetto alla popolazione generale affetta dalla stessa malattia.
Incidenza e prevalenza della demenza di Alzheimer
La malattia di Alzheimer è presente a livello globale: si stima infatti che 47 milioni di persone in tutto il mondo soffrano di questa malattia. Le stime dell’incidenza della demenza dipendono fortemente dall’età: in generale, l’incidenza della demenza raddoppia ogni 10 anni dopo i 60 anni.
Nello studio longitudinale “Cardiovascular Health Study – Cognition Study (CHS-CS)”, solo 19 dei 160 partecipanti vivi all’età di 93 anni sono rimasti esenti da un deterioramento cognitivo lieve o da una forma di demenza.
C’è pochissima differenza tra i sessi nell’incidenza e nella prevalenza della demenza di Alzheimer. In termini assoluti, ci sono più donne che uomini affetti dalla malattia, poiché le donne vivono in media più a lungo.
Numerosi studi hanno riportato che la prevalenza della demenza potrebbe diminuire nel tempo nei paesi ad alto reddito. Uno studio basato sulla popolazione a Rotterdam ha riportato una diminuzione dell’incidenza della demenza correlato ad un incremento medio del volume cerebrale. Ad esempio, in un altro articolo abbiamo trattato di danza e invecchiamento.
Patogenesi, caratteristiche e alterazioni
Tutte le forme di malattia di Alzheimer sembrano condividere la sovrapproduzione e/o la ridotta rimozione dei peptidi beta-amiloidi. La patogenesi della malattia di Alzheimer coinvolge anche una seconda proteina, chiamata proteina tau. La proteina Tau è associata ai microtubuli, strutture intracellulari responsabili del transito di organuli e vescicole all’interno delle cellule. Nella malattia di Alzheimer, la proteina tau diventa iperfosforilata e si aggrega, accumulandosi in eccesso, divenendo così altamente tossica per i neuroni.
I cambiamenti anatomo-patologici essenziali della malattia di Alzheimer sono caratterizzati da:
- Depositi extracellulari di peptidi della sostanza beta-amiloide;
- Formazione di placche neuritiche, associate a danno dei neuroni;
- Degenerazione neurofibrillare, meglio esemplificata dai grovigli neurofibrillari;
- Perdita di neuroni colinergici, cioè quelli che producono il principale neurotrasmettitore che favorisce la memoria e l’apprendimento, l’acetilcolina.
Oltre a queste caratteristiche che potremmo definire essenziali, molti altri cambiamenti patologici sono comunemente osservati nella malattia di Alzheimer. Ad esempio, l’angiopatia amiloide cerebrale; la presenza dei corpi di Lewy; le lesioni cerebrali vascolari; la sclerosi ippocampale (HS) con perdita di cellule piramidali nell’ippocampo (fondamentale per la memoria), inclusioni immunoreattive della proteina legante il DNA TAR 43 (TDP-43) e altro ancora.
I sintomi dell’Alzheimer
Sintomatologia
La compromissione della memoria è il sintomo iniziale più comune della demenza di Alzheimer. Il modello di deterioramento delle facoltà mnemoniche, infatti, è distintivo della malattia e facile da comprendere.
La memoria episodica dichiarativa, ovvero il ricordo degli eventi accaduti in un particolare momento e luogo, è profondamente intaccata nella malattia di Alzheimer. Questo tipo di memoria dipende fortemente dall’ippocampo e da altre strutture del lobo temporale mediale che, come vedremo, vengono fortemente compromesse.
All’interno della memoria episodica, c’è una distinzione tra memoria di eventi recenti e memoria di eventi più distanti (memoria remota). La prima delle due è notevolmente intaccata già nella prima fase della patologia. La seconda, che possiede i ricordi consolidati che possono essere richiamati senza la funzione dell’ippocampo, è al contrario conservata sino alle fasi avanzate della malattia.
Anche la memoria procedurale e l’apprendimento motorio sono relativamente risparmiati fino a uno stadio piuttosto avanzato. La memoria di vocaboli e concetti (memoria semantica) spesso viene compromessa un po’ più tardi.
Caratteristiche dei deficit di memoria
I deficit di memoria si sviluppano insidiosamente e progrediscono lentamente nel tempo. La ridotta percezione dei propri deficit (anosognosia) è una caratteristica comune: è frequente, infatti, che i pazienti sottovalutino i propri episodi di smemoratezza e offrano alibi o spiegazioni quando vengono segnalati.
È altrettanto comune anche la perdita di insight (la capacità di vedere “dentro” una situazione, o dentro sé stessi), più tipica di alcune malattie neurodegenerative come la demenza fronto-temporale, che può essere associata a disturbi comportamentali.
Coloro con una visione introspettiva relativamente conservata hanno maggiori probabilità di essere depressi, poiché si accorgono dei propri deficit. I pazienti con una visione più compromessa probabilmente saranno agitati e disinibiti, mostrando caratteristiche psicotiche.
Sintomi neuropsichiatrici della demenza di Alzheimer
I sintomi neuropsichiatrici sono comuni nella malattia di Alzheimer, in particolare lungo il suo decorso. Questi possono iniziare con sintomi relativamente sottili tra cui apatia, disimpegno sociale e irritabilità. L’apatia può talvolta essere difficile da distinguere dalla depressione.
Più problematica ai fini della gestione del paziente è l’insorgenza di disturbi comportamentali, tra cui agitazione, aggressività, vagabondaggio e psicosi. Quest’ultima può portare ad allucinazioni, deliri, sindromi da errata identificazione.
I disturbi del sonno sono comuni nei pazienti con malattia di Alzheimer, che hanno un sonno più frammentato rispetto ai coetanei sani. Tali cambiamenti possono verificarsi molto precocemente nel processo patologico.
Fasi dell’Alzheimer
Molte persone, consapevoli che i problemi di memoria rappresentano la caratteristica principale della demenza, temono che i piccoli problemi di memoria avvertiti siano legati alla malattia di Alzheimer precoce. Tuttavia, alcuni problemi sono normali e legati solo all’invecchiamento, e non ad una demenza progressiva.
I normali cambiamenti legati all’età causano spesso piccole difficoltà con la memoria immediata, ad esempio non ricordare un numero di telefono, una serie di indicazioni stradali o i nomi propri, anche quelli molto familiari. I cambiamenti della memoria dovuti al normale invecchiamento sono generalmente lievi e non peggiorano notevolmente nel tempo. Inoltre, non interferiscono con il funzionamento quotidiano di una persona.
Quando i sintomi connessi con problemi di memoria peggiorano nel tempo, e interferiscono con il funzionamento quotidiano, allora è necessario indagare. Se i deficit sono minori, causando disturbi di lieve entità senza alcuna compromissione della capacità di eseguire le attività della vita di ogni giorno, si parla di deterioramento cognitivo lieve (MCI).
Poiché il deterioramento può progredire fino alla demenza vera e propria, le persone con questa condizione dovrebbero essere sottoposte ad un monitoraggio più attento per individuare prontamente segni di demenza.
Primi sintomi
I primi segni della malattia di Alzheimer sono graduali e spesso subdoli. Molte persone e le loro famiglie notano innanzitutto la difficoltà nel ricordare eventi o informazioni recenti. Ciò che emerge è la tendenza a ripetere di continuo storie, domande o richieste anche quando già soddisfatte. In particolar modo, tra i primi sintomi ci sono:
- Difficoltà con il linguaggio (ad esempio, non riuscire a trovare le parole giuste per descrivere le cose);
- Difficoltà di concentrazione e di ragionamento;
- Problemi con compiti complessi come pagare le bollette, cucinare o far quadrare il libretto degli assegni;
- Perdersi in un luogo familiare.
Man mano che la malattia di Alzheimer progredisce, le capacità cognitive di una persona continuano a diminuire e alcune o tutte le difficoltà elencate possono diventare sempre più importanti. Inoltre, possono manifestarsi alterazioni della personalità o del comportamento: rabbia, ostilità, comportamento aggressivo possono comparire nelle fasi tardive della malattia. In alternativa, alcune persone iniziano a soffrire di depressione o mostrano scarso interesse per l’ambiente circostante (apatia).
Tra gli altri sintomi che possono comparire nella fase tardiva dell’Alzheimer: problemi del sonno, allucinazioni, deliri, disorientamento temporo-spaziale. I pazienti hanno bisogno di aiuto per compiti di base (come mangiare, lavarsi e vestirsi), e manifestano incontinenza (difficoltà a controllare la vescica e/o l’intestino).
Il numero o il tipo di sintomi, le funzioni compromesse e la velocità con cui gli stessi sintomi progrediscono possono variare ampiamente da persona a persona.
In alcune persone, la demenza grave si manifesta entro cinque anni dalla diagnosi; per altri, la progressione può richiedere più di 10 anni.
L’Alzheimer di per sé solitamente non è letale. La maggior parte dei pazienti non muore a causa della malattia stessa, ma piuttosto per una malattia secondaria come la polmonite o infezioni urinarie, oppure ancora per complicanze a seguito di una caduta o di un’altra patologia intervenuta nel frattempo.

Diagnosi e trattamento
Diagnosi dell’Alzheimer
La malattia di Alzheimer dovrebbe essere sospettata in qualsiasi anziano che presenta la sintomatologia precedentemente descritta con esordio insidioso e progressivo peggioramento e con almeno un altro dominio cognitivo che porti ad una compromissione nel proprio funzionamento sociale. Pertanto, un esame cognitivo e neurologico generale dettagliato è fondamentale.
Per diagnosticare la demenza e identificarne il tipo, sono essenziali le informazioni raccolte interagendo con il paziente e con i suoi familiari. Altrettanto importanti in genere sono i test di memoria e altri esami cognitivi per valutare il grado di difficoltà della persona con sospetta malattia. I risultati di questi test possono poi essere monitorati nel tempo osservando se il funzionamento cognitivo rimane lo stesso o se invece diminuisce.
Molti medici utilizzano scale standardizzate come il Mini-Mental State Examination (MMSE) o il Montreal Cognitive Assessment (MoCA) per documentare la presenza e la progressione della demenza.
La valutazione neuropsicologica può essere utile per una varietà di motivi e soprattutto per stabilire una linea di base per seguire il paziente nel tempo o aiutare a differenziare tra diverse forme di demenze identificando le relative strategie di trattamento. Di solito vengono eseguiti esami del sangue per scoprire se uno squilibrio chimico o ormonale o una carenza vitaminica contribuiscono alle difficoltà del soggetto. In genere, tra i test di laboratorio vengono richiesti il dosaggio di folati, vitamina B12, vitamina D, omocisteina e ormoni tiroidei.
Imaging cerebrale
L’imaging cerebrale – solitamente tramite tomografia computerizzata (TC) o risonanza magnetica per immagini (MRI) – viene spesso eseguito nelle persone affette da demenza per capire lo stato del problema. In particolare, la risonanza magnetica cerebrale può documentare potenziali diagnosi alternative o aggiuntive. Il reperto focale più caratteristico della malattia di Alzheimer è la riduzione del volume dell’ippocampo o l’atrofia del lobo temporale mediale. A volte la risonanza magnetica può anche aiutare gli operatori sanitari a identificare il tipo preciso di demenza, poiché i diversi tipi possono presentare cambiamenti cerebrali caratteristici.
La tomografia a emissione di positroni (PET) o la tomografia computerizzata a emissione di fotone singolo (SPECT), altre forme di esami radiologici del cervello, possono mostrare i depositi proteici anomali presenti in alcune persone che soffrono della malattia di Alzheimer o le caratteristiche che permettono di distinguerla da altre patologie.
Trattamento della demenza
L’approccio terapeutico dipende in parte dal tipo di demenza di una persona e dal suo stadio al momento della diagnosi.
Farmaci per la demenza di Alzheimer
È importante avere aspettative realistiche sui potenziali benefici della terapia farmacologica nella malattia di Alzheimer. Al momento, purtroppo, nessun farmaco cura la malattia in toto e la realtà è che col tempo la persona continuerà a peggiorare. Quando i medicinali hanno effetto, l’obiettivo non è arrestare la progressione della malattia ma rallentarla. Ciò permette di migliorare, per quanto più tempo possibile, la qualità della vita della persona e della sua famiglia.
Gli esperti, tuttavia, stanno studiando trattamenti nella speranza di trovare un modo per rallentare maggiormente la progressione del declino mentale e funzionale, insieme agli sforzi scientifici per prevenirne o ritardarne l’insorgenza.
Attualmente sono disponibili diversi farmaci per il trattamento dei problemi di memoria associati alla malattia di Alzheimer, utilizzati anche in persone con altre forme di demenza.
Tre di essi sono donepezil, rivastigmina e galantamina: questi farmaci consentono al neurotrasmettitore chiamato acetilcolina di non essere degradato e pertanto di permanere più a lungo nelle sinapsi cerebrali.
Un altro farmaco oggi disponibile è la memantina, che può limitare o rallentare i danni causati dalla malattia di Alzheimer agendo come antagonista dei recettori del glutammato, una sostanza spesso responsabile di alcune malattie neurodegenerative. Può essere associato agli anticolinesterasici e ad altri farmaci utilizzati in combinazione, come i precursori colinergici (citicolina, colina alfoscerato).
Nuovi farmaci per l’Alzheimer
Nuovi farmaci biologici per la demenza di Alzheimer
Nel 2021, dopo anni di tentativi per trovare farmaci in grado di ridurre la proteina amiloide associata alla malattia di Alzheimer, un farmaco chiamato aducanumab (nome commerciale: Aduhelm) è stato approvato negli Stati Uniti per il trattamento delle persone con malattia in forma lieve e ne abbiamo parlato in un precedente articolo. Il farmaco agisce riducendo la quantità di placche amiloidi nel cervello: in alcune persone, questo potrebbe aiutare a rallentare la progressione della patologia, sebbene non possa invertire la perdita di memoria già avvenuta e soprattutto non possa curare la malattia nel suo complesso. Un secondo farmaco di questa classe, il lecanemab (Leqembi), è stato approvato dalla Food and Drug Administration (FDA) statunitense nel 2023, seguito da un terzo, il donanemab, a inizio luglio 2024.
Sebbene siano da molti considerati farmaci rivoluzionari, per differenza rispetto alla precedente sostanziale assenza di medicinali idonei, molto spesso tutti e tre apportano solo effetti benefici lievi e di modesta entità, con degli svantaggi considerevoli: sono costosi, richiedono un monitoraggio intensivo e hanno effetti collaterali marcati.
Il Donanemab, o Kisunla
Donanemab, noto anche come N3pG e commercializzato dall’azienda farmaceutica Eli Lilly con il nome di Kisunla, è un anticorpo monoclonale umanizzato diretto contro un elemento presente nelle placche amiloidi.
Al pari degli altri farmaci citati, esso non cura la malattia, ma negli studi clinici è stato dimostrato che rallenta la progressione dell’Alzheimer, cosa che consente alle persone di avere più tempo per partecipare alla vita quotidiana e vivere in modo indipendente.
Come abbiamo già visto, la proteina amiloide è una proteina prodotta naturalmente nel corpo che può aggregarsi per creare placche amiloidi: l’eccessivo accumulo di queste ultime nel cervello può portare a problemi di memoria e di pensiero.
Il donanemab può aiutare il corpo a rimuovere l’eccessivo accumulo di placche amiloidi, rallentando il declino cognitivo dovuto alla malattia. La logica alla base della composizione di questo farmaco è colpire la placca amiloide già formata per ridurre la quantità di proteina amiloide esistente nel cervello, piuttosto che semplicemente prevenire la deposizione di nuove placche o la crescita di quelle esistenti.
Uno studio ha dimostrato come il donanemab si leghi a circa un terzo delle placche amiloidi presenti nel cervello, reagendo fortemente con il nucleo delle placche stesse, e riducendo la presenza della proteina che le compone.
Lo studio Trailblazer-ALZ 2
Nello studio di fase 3 intitolato “Trailblazer-ALZ 2”, si è osservato che il donanemab ha rallentato significativamente il declino clinico della demenza di Alzheimer in tutte le persone coinvolte nella sperimentazione, con condizioni lievi di malattia. Il farmaco ha ridotto le placche amiloidi in media del 61% a 6 mesi, dell’80% a 12 mesi e dell’84% a 18 mesi rispetto all’inizio dello studio.
Il donanemab è stato quindi approvato negli Stati Uniti per il trattamento della demenza di Alzheimer sintomatica precoce. Tale stadio comprende persone con decadimento cognitivo lieve (MCI) e persone con stadio di demenza lieve. Tuttavia, ora occorre osservare un numero maggiore di risultati sul campo, e soprattutto su larga scala, per dimostrare il vero valore di questo farmaco.
Al momento in cui scriviamo, in Europa il Donanemab ancora non è arrivato ma presto sarà presente anche nel vecchio continente.
Trattamento dei sintomi comportamentali
Come abbiamo visto precedentemente, anche nelle prime fasi della malattia possono verificarsi disturbi psichici che vanno dalla depressione all’agitazione, ansia e irritabilità che generalmente peggiorano con l’avanzare del morbo di Alzheimer. Una combinazione di farmaci e terapia comportamentale può essere utile nell’affrontarlo.
La depressione è comune (anche nei caregiver e ne abbiamo parlato qui), soprattutto nelle prime fasi della demenza, ma può essere trattata con terapia comportamentale e/o con farmaci specifici. Quelli potenzialmente utili includono un gruppo noto come inibitori selettivi della ricaptazione della serotonina, o SSRI: i più ampiamente utilizzati includono fluoxetina, sertralina, paroxetina, citalopram ed escitalopram.
Tra gli altri farmaci impiegati come antidepressivi, possono essere utilizzati duloxetina, venlafaxina, mirtazapina, trazodone e vortioxetina.
Comportamento aggressivo al posto della depressione
Uno dei problemi più difficili per i familiari e per gli operatori sanitari è il possibile comportamento aggressivo delle persone con demenza di Alzheimer. Fortunatamente questo fenomeno non è comune, ma in alcuni casi il comportamento diventa fisicamente violento man mano che la demenza progredisce.
Agitazione e aggressività possono essere causate o acuite da una serie di fattori, tra cui confusione, allucinazioni, depressione o ansia, disturbi del sonno, dolore o disagio per la propria condizione.
I deliri, sono comuni nei pazienti affetti da demenza e si verificano in circa il 30% dei pazienti con malattia avanzata. I deliri paranoidi sono particolarmente dolorosi per i pazienti. Essi includono la convinzione che qualcuno abbia invaso la casa; che i membri della famiglia siano stati sostituiti da impostori; che i coniugi siano stati infedeli o che i beni personali siano stati rubati.
I farmaci usati per trattare i deliri nei disturbi psichiatrici talvolta non sono utili nei casi originati da demenza.
Problemi di sonno
I disturbi del sonno possono essere trattati con farmaci o cambiamenti comportamentali, come ad esempio limitando i sonnellini diurni, aumentando l’attività fisica, evitando di assumere caffeina e alcol alla sera.
In alcune persone possono essere raccomandati alcuni farmaci per favorire il sonno, sebbene questi possano determinare peggioramento della confusione e aumento del rischio di cadute.
Mantenere i ritmi quotidiani, ed evitare esposizioni alla luce intensa durante la notte possono aiutare a mantenere i normali cicli di veglia e sonno.
Bibliografia
- Gareri P, et al, “Retrospective Study on the Benefits of Combined Memantine and cholinesterase inhibitor treatment in aged patients affected with Alzheimer’s Disease: The MEMAGE Study”, J Alzheimers Dis, 2014;
- Gareri P, et al, “The Citicholinage Study: Citicoline Plus Cholinesterase Inhibitors in Aged Patients Affected with Alzheimer’s Disease Study”, J Alzheimers Dis, 2017;
- Gareri P, et al, “Citicoline: A Cholinergic Precursor with a Pivotal Role in Dementia and Alzheimer’s Disease”, J Alzheimers Dis, 2024;
- Alzheimers.gov, Clinical Trials, U.S. National Institute on Aging & National Institutes of Health;
- Erin Bryant, et al, “Study reveals how APOE4 gene may increase risk for dementia”, National Institute on Aging, 2021;
- Alzheimer’s Association, “What is Alzheimer’s Disease? Symptoms & Causes”, 2024;
- Kuller LH, et al, “Dementia and Alzheimer’s disease: a new direction. The 2010 Jay L. Foster Memorial Lecture”, Alzheimers Dement, 2011;
- Philip Scheltens et al, “Alzheimer’s disease”, Lancet, 2021;
- Masliah E, et al, “Diffuse plaques do not accentuate synapse loss in Alzheimer’s disease”, Am J Pathol, 1990;
- Terry RD, et al, “Physical basis of cognitive alterations in Alzheimer’s disease: synapse loss is the major correlate of cognitive impairment”, Ann Neurol, 1991;
- Braak H, et al, “Neuropathological stageing of Alzheimer-related changes”, Acta Neuropathol, 1991;
- Braak H, et al, “Staging of Alzheimer disease-associated neurofibrillary pathology using paraffin sections and immunocytochemistry”, Acta Neuropathol, 2006;
- Mirra SS, et al, “The Consortium to Establish a Registry for Alzheimer’s Disease (CERAD). Part II. Standardization of the neuropathologic assessment of Alzheimer’s disease”, Neurology, 1991;
- National Institutes of Health (NIH), “NIH-funded research provides new clues on how ApoE4 affects Alzheimer’s risk”, 2012;
- Amador-Ortiz C, et al, “Neuropathology of hippocampal sclerosis”, Handb Clin Neurol, 2008;
- Josephs KA, et al, “Rates of hippocampal atrophy and presence of post-mortem TDP-43 in patients with Alzheimer’s disease: a longitudinal retrospective study”, Lancet Neurol, 2017;
- Josephs KA, et al, “Abnormal TDP-43 immunoreactivity in AD modifies clinicopathologic and radiologic phenotype”, Neurology, 2008;
- American Psychiatric Association (APA), “Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition, Text Revision (DSM-5-TR)”, 2023;
- Jason Weller, et al, “Current understanding of Alzheimer’s disease diagnosis and treatment”, Review F1000Res, 2018;
- Qi Feng, et al, “MRI Radiomics Classification and Prediction in Alzheimer’s Disease and Mild Cognitive Impairment: A Review”, Current Alzheimer Research, 2020.
Hai bisogno di un parere su questa condizione?

Dott. Pietro Gareri
30 minuti - 70 € 35 anni di esperienza Specialista in Medicina Interna e Geriatria Richiedi una televisita con: Dott. Pietro GareriGarantito in 24 ore! Con questo specialista o un suo collega.

Categorie
- Allergie e intolleranze
- Apparato Urogenitale
- Autismo e Disturbi dello Spettro Autistico
- Benessere Psichico e Salute mentale
- Caduta dei Capelli
- Coronavirus
- Disfunzioni della Tiroide
- Disturbi Alimentari
- Disturbi del Sonno
- Disturbi Gastrointestinali
- Epidemie e pandemie
- Farmaci - Terapie - effetti collaterali
- Malattie Autoimmuni
- Malattie infettive
- Malattie Infiammatorie
- Malattie Respiratorie
- Malattie Reumatiche
- News
- Patologie Cardiovascolari
- Patologie del Piede
- Patologie del Sangue e della Coagulazione
- Patologie del Sistema Nervoso
- Patologie della Pelle
- Patologie Oculari
- Prevenzione e salute
- Problemi Muscoloscheletrici
- Salute dei Bambini
- Salute dell'Anziano
- Salute della Donna
- Telemedicina
- Terapie e Rimedi Naturali
- Terapie Oncologiche
- Viaggi e Salute
- Video
- Vivere con il Diabete


 ggg
ggg