Da anemia ferro carenziale a malattia sideropenica
20 Settembre 2022
Anemia da Carenza di Ferro: la forma più comune di Anemia
L’anemia da carenza di ferro, nota anche come anemia sideropenica o anemia marziale, è la tipologia più diffusa di anemia ed è Il deficit nutrizionale più frequente nella società moderna. Questa condizione si verifica quando l’organismo presenta livelli insufficienti di ferro, compromettendo il trasporto di ossigeno nel sangue e causando sintomi come stanchezza e fiato corto.
Che cos’è l’anemia da carenza di ferro?
Il ferro è un minerale essenziale per diverse funzioni biologiche, in particolare per la formazione dell’emoglobina, la proteina che trasporta l’ossigeno nel sangue. Una carenza di ferro può derivare da:
- Scarso apporto alimentare: diete povere di ferro, specialmente in vegetariani e vegani, possono ridurre i livelli di ferro.
- Problemi di assorbimento: disturbi gastrointestinali come la celiachia o la malattia di Crohn possono interferire con l’assorbimento del ferro.
- Perdite ematiche: sanguinamenti abbondanti durante il ciclo mestruale, ulcere gastrointestinali o emorragie possono ridurre le riserve di ferro.
Questa condizione determina una produzione insufficiente di emoglobina, che a sua volta riduce la capacità del sangue di trasportare ossigeno, alterando vari processi metabolici.
Chi è più a rischio?
L’anemia sideropenica può colpire persone di tutte le età, ma alcune categorie sono particolarmente vulnerabili:
- Bambini e adolescenti: la crescita rapida aumenta il fabbisogno di ferro.
- Donne in età fertile: le perdite di sangue durante il ciclo mestruale possono ridurre i livelli di ferro.
- Gravidanza e allattamento: il fabbisogno di ferro aumenta significativamente per supportare la crescita fetale e la produzione di latte.
L’Epidemiologia della CARENZA MARZIALE/ANEMIA FERRO – CARENZIALE
La Carenza Marziale pre-anemica (Carenza Marziale) e l’anemia ferro-carenziale (Anemia Ferro – Carenziale) e anemia sideropenica sono tra le condizioni morbose più diffuse al mondo, che nei paesi a risorse limitate interessano fino ai due terzi della popolazione. Nelle società a tenore di vita occidentale le ampie possibilità nutrizionali hanno indotto a sottostimare l’evenienza di deficit nutrizionali “marginali”, spesso subclinici, quali la CARENZA MARZIALE. (1-3)
Hai bisogno di un parere su questa condizione?

Dott. Giovanni Schininà
30 minuti - 70 € 8 anni di esperienza Specialista in Ematologia Richiedi una televisita con: Dott. Giovanni SchininàGarantito in 24 ore! Con questo specialista o un suo collega.
In Europa le stime più recenti evidenziano come la CARENZA MARZIALE/ANEMIA FERRO – CARENZIALE interessi meno del 2% dei lattanti nel primo semestre di vita, il 2-3% nel secondo semestre, il 3-9% dei bambini della prima e seconda infanzia, il 3. 5–13% dei maschi adolescenti, l’11-33% nelle femmine adolescenti, l’1% dei maschi < 50 anni ed il 2-4% di quelli > 50 anni, il 6-7% degli anziani, il 9-11% delle donne in età fertile ed il 5-7% di quelle in post-menopausa (1-5).
La Fig. 1 riporta i dati della più recente ed ampia indagine demografica che riguarda la popolazione italiana condotta nel 2013 dal gruppo di Masotti. (6)
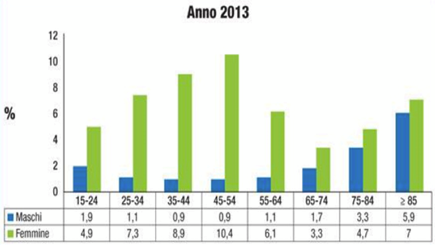
Fig. 1 Distribuzione prevalenza Anemia Ferro – Carenziale in Italia negli adulti.
La Fisiopatologia del Ferro
Il metabolismo del ferro è un “sistema chiuso” in cui il metallo dell’organismo è continuamente riciclato per soddisfare le richieste dei vari compartimenti. La quantità totale di ferro presente nel soggetto adulto è di 4-5 g nel maschio, 3,5-4 g nella femmina mestruata. È suddivisibile in due compartimenti (Fig. 2):
1) ferro metabolicamente attivo (circa 80%) costituito quasi esclusivamente da eme-proteine ovvero da proteine con un gruppo prostetico ferroporfirinico la cui funzione è correlata essenzialmente al metabolismo ossidativo.
- ferro emoglobinico
- ferro mioglobinico
- ferro di trasporto
- ferro-emico in altri tessuti: citocromi mitocondriali, perossidasi, catalasi.
2) ferro di deposito (circa 20%) sotto forma di ferritina ed emosiderina
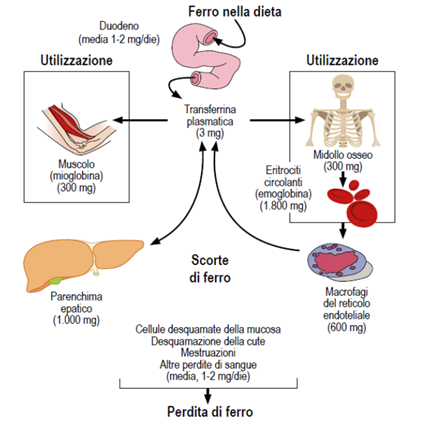
Fig. 2 Metabolismo del ferro
Assorbimento e perdite, in costante equilibrio, interessano solo l’1% dell’intero pool marziale.
Le perdite fisiologiche, se si escludono quelle mestruali, sono minime (circa 0,5-1 mg/die) e sono per lo più dovute ad esfoliazioni delle mucose (intestino, reni e polmoni) e della cute. (1-3)
La dieta occidentale contiene circa 6 mg di ferro/1000 calorie, con un apporto giornaliero di 15-20 mg di ferro. Secondo i LARN-2014 il fabbisogno giornaliero di ferro alimentare è di 7 mg nell’uomo e di 10 mg nella donna. Il ferro della dieta è presente in due forme: emico (10%) e non-emico (90%).
Quello emico si trova in alimenti di origine animale (carne rossa, pollo, pesce) come emoglobina o mioglobina; viene assorbito tra il 15% e il 20%. Quello non-emico, o inorganico, è presente negli alimenti di origine vegetale ed in alcuni alimenti di origine animale come latte e uova; ne viene assorbito meno del 5%. (1-3).
La Fig. 3 racconta il complesso meccanismo dell’assorbimento del ferro.
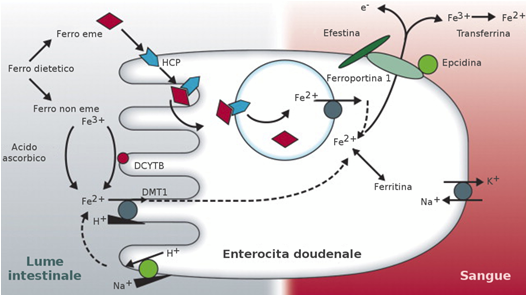
Fig. 3 Assorbimento del ferro a livello intestinale.
Le Principali Cause della Carenza Marziale/ANEMIA FERRO – CARENZIALE.
Le principali cause di CARENZA MARZIALE sono riconducibili a diminuite riserve alla nascita (interessa solo i bambini della prima infanzia), inadeguato apporto con la dieta o aumentato fabbisogno, ridotto assorbimento o perdite croniche di sangue. (Tab. 1) In alcuni pazienti possono concorrere più eventi causali.
In questa revisione non sono trattate le forme cosiddette “funzionali” che si osservano in corso di malattie infiammatorie/infettive/autoimmuni croniche nelle quali il ferro dell’organismo non è necessariamente carente ma rimane “intrappolato” nel sistema macrofagico-istiocitario e non è disponibile per l’eritropoiesi. (1-3,7-10).
Hai bisogno di un parere su questa condizione?

Prof. Roberto Miniero
30 min - 70 € 53 anni di esperienza Specialista in Ematologia, Pediatria e Chirurgia pediatrica Richiedi una televisita con: Prof. Roberto MinieroGarantito in 24 ore! Con questo specialista o un suo collega.
Tab. 1 Principali cause di CARENZA MARZIALE. (1-3)
| Inadeguate scorte alla nascita: prematurità, gemellarità, exanguino-trasfusione, grave ANEMIA FERRO – CARENZIALE nella madre, precoce clampaggio del cordone ombelicale. Inadeguato apporto: svezzamento tardivo, dieta incongrua (diete vegetariane-vegane non controllate), ridotta assunzione legata a povertà e malnutrizione. Aumentato fabbisogno: condizioni di rapido accrescimento staturo-ponderale quali basso peso alla nascita, prematurità, sviluppo adolescenziale, cardiopatie cianotizzanti, gravidanza (soprattutto II e III trimestre), allattamento, intensa attività sportiva agonistica o amatoriale. |
| Ridotto assorbimento (interessa prevalentemente il ferro non-emico): Malattia Celiaca (MC) ed altre condizioni di malassorbimento quali le malattie infiammatorie croniche intestinali (MICI), acloridria, Malattia. di Hirschsprung, ampie resezioni intestinali (intestino corto), uso di antiacidi ed inibitori di pompa protonica che aumentano il ph gastrico, eccesso nella dieta calcio, di fitati (soia e cereali), crusca, amido, calcio, polifenoli e tannini (the e caffe), proteine della soia, la caseina e l’albume d’ uovo, infezione da Helicobacter pylori, Giardiasi ed altre parassitosi intestinali (rare in Europa), obesità, chirurgia bariatica, deficit immunitari con atrofia della mucosa, linfangectasia intestinale, miocardiopatia cronica (edema della mucosa intestinale). |
| Perdite croniche di sangue: mestruazioni abbondanti e/o frequenti, menorragie*, diverticolo di Meckel, ernia iatale, varici esofagee, gastrite, ulcera gastrica, malformazioni artero-venose intestinali, polipi, Malattia di Crohn, rettocolite ulcerosa, coliti aspecifiche, poliposi, emorroidi, angiomi, tumori apparato gastroenterico, tumori ginecologici, epistassi recidivanti, donazioni periodiche di sangue, ematuria persistente, tubercolosi, bronchiectasie, coagulopatie, emodialisi, maratoneti**, uso prolungato di aspirina, cortisonici, FANS, perdite nosocomiali (frequenti prelievi di sangue a scopo diagnostico soprattutto nel neonato e nel piccolo lattante ricoverati in terapia intensiva, ma anche negli adulti in situazioni complesse), autoflebotomie, rare forme di Sindrome di Munchausen, consumo di latte vaccino***. parassitosi tropicali che interessano l’intestino e il sistema genitourinario****. *Un flusso mestruale medio è di 35 ml (con punte fino ad 80 ml nel 10% delle donne) che equivale ad una perdita di circa 0,5 mg di ferro per ogni ml di sangue. **Sport con allenamenti intensi e prolungati, in particolare sono interessati i maratoneti. Per questi atleti oltre all’aumento della massa muscolare, è possibile che intervengano un ridotto assorbimento provocato da uno stato di infiammazione cronica, un’eventuale emoglobinuria da emolisi indotta dal microtraumatismo da marcia e microsanguinamenti intestinali. *** Allergia alle proteine latte vaccino (bambini prima e seconda infanzia), consumo di latte vaccino non formulato nei primi 12 mesi di vita, consumo di latte superiore ai 700 cc al giorno nei bambini più grandi e negli adulti. **** Elmintiasi intestinali come il Necator Americanus e Ancylostoma duodenale, parassitosi come lo Schistosoma mansoni (intestino) e Schistosoma haematomium (vie urinarie) e Trichuris Trichuria. Questi parassiti sono presenti anche nel Sud degli Stati Uniti, nel Nord dell’Argentina, nel Centro America, in Africa ed in Asia arrivando a colpire fino al 20% della popolazione, e nei paesi che si affacciano sul Mediterraneo. Praticamente assenti in Europa (mancano tuttavia dati aggiornati) |
| Forme ereditarie (malattie rare): sono oltre 60 le forme identificate finora tra le quali il Deficit di DMT1, il deficit di transferrina, l’Anemia Ferro-Carente Ferro-Refrattaria (IRIDA), la atransferrinemia, la aceruloplasminemia e l’emocromatosi. |
| Malattie polmonari croniche: Emosiderosi polmonare, fibrosi cistica, displasie broncopolmonari. |
| Senectute. Il soggetto anziano è a rischio per CARENZA MARZIALE multifattoriale: inadeguato apporto, ridotto assorbimento e perdite ematiche croniche. |
La Clinica della CARENZA MARZIALE/ANEMIA FERRO – CARENZIALE
Il ferro svolge un ruolo fondamentale in numerosi processi metabolici in differenti organi e tessuti, intervenendo in oltre 180 reazioni biochimiche, la principale delle quali è la fosforilazione ossidativa. La sua carenza non si riflette quindi solo sull’eritropoiesi ma ha conseguenze anche a livello sistemico (1-3,7-10).
La CARENZA MARZIALE decorre per lo più asintomatica o può manifestarsi con astenia e/o scarsa tolleranza all’esercizio fisico. Con l’aggravarsi della carenza i sintomi, ascrivibili soprattutto alla ridotta quantità di mioglobina e degli enzimi responsabili della fosforilazione ossidativa, diventano più marcati. (1-3,7,8) Quando compare l’anemia si osserva pallore anitterico.
Nel 10% dei pazienti può essere presente modesta splenomegalia in conseguenza di una lieve emolisi. La riduzione dell’emoglobina è lenta e graduale. La sintomatologia è variabile e, almeno nelle fasi iniziali, aspecifica. Il paziente, se non coesistono patologie cardio-respiratorie, riesce a compensare la scarsa ossigenazione tissutale e a raggiungere livelli di emoglobina significativamente ridotti (Hb <7 g/dl) senza manifestazioni cliniche rilevanti a riposo, ad eccezione di una modesta tachicardia e tachipnea.
Questa buona tolleranza è da ricondursi soprattutto ad un aumento della 2-3-DPG nei globuli rossi che, determinando uno spostamento a destra della curva di dissociazione dell’emoglobina, consente un maggior rilascio di ossigeno ai tessuti (1-3).
Il bambino con ANEMIA FERRO – CARENZIALE può manifestare inappetenza, scarsa voglia di giocare, irritabilità, astenia, svogliatezza, cefalea, ridotta performance scolastica. Nei casi più gravi e con anemia di lunga durata possono manifestarsi deficit intellettivi, dell’attenzione, della memoria, dell’apprendimento, della motricità fine e della fluidità verbale.
È stata evidenziata una associazione tra CARENZA MARZIALE/ANEMIA FERRO – CARENZIALE e rischio di stroke, ipertensione endocranica idiopatica, paralisi dei nervi cranici, disturbi del sonno e crisi convulsive febbrili. (2,3). Il meccanismo alla base della compromissione delle funzioni nervose non è del tutto chiarito. Una possibile ipotesi è che la CARENZA MARZIALE determini alterazioni a livello dei neurotrasmettitori, deficit di mono-amino-ossidasi ferro dipendenti e difetti di mielinizzazione. (1-3,7-10) Nell’adulto oltre ad inappetenza, irritabilità, astenia, svogliatezza, cefalea, si possono manifestare deficit di attenzione e ridotta performance lavorativa. (1,7,8)
La carenza di ferro di lunga durata può causare glossite, cheilosi angolare, disfagia fino ad una sindrome di Plummer-Vinson, riduzione dell’acidità gastrica, distrofia ungueale, capelli radi fino alla alopecia, amenorrea e deficit immunologici (riduzione dei linfociti e della risposta linfocitaria e della attività fagocitica dei neutrofili). (1-3) Nei bambini può condurre ad un rallentamento della crescita e, nelle forme gravi (rare nel contesto sociale occidentale), si può osservare la pica, la geofagia e/o pagofagia. (1-3).
Studi recenti hanno dimostrato soprattutto nel paziente adulto un rapporto tra carenza di ferro ed evoluzione sfavorevole dello scompenso cardiaco cronico. (11) È stata anche segnalata una correlazione, nei soggetti con età >65 anni, tra ANEMIA FERRO – CARENZIALE declino della capacità cognitiva e demenza senile.
Il Laboratorio per la Diagnosi di CARENZA MARZIALE/ANEMIA FERRO – CARENZIALE
La valutazione di parametri ematochimici quali sideremia, transferrinemia e ferritinemia, e quella dell’esame emocromocitometrico forniscono dati sulla deplezione di ferro ne misurano l’impatto sulla eritropoiesi
La Tab. 2 riporta i valori normali dei parametri eritrocitari in relazione dell’età.
| Età | Hb* (gr/dl) | Ht* (%) | GR* (102/l) | MCV* (fl) | MCH* (pg) | MCHC* (g/dl) | ||||||
| Valore medio | – 2 DS | Valore medio | – 2 DS | Valore medio | – 2 DS | Valore medio | – 2 DS | Valore medio | – 2 DS | Valore medio | – 2 DS | |
| Nascita | 16. 5 | 13. 5 | 51 | 42 | 4. 7 | 3. 9 | 108 | 98 | 34 | 31 | 33 | 30 |
| 3 – 6 mesi | 11. 5 | 9. 5 | 35 | 29 | 3. 8 | 3. 1 | 91 | 74 | 30 | 25 | 33 | 30 |
| 0. 5 – 2 anni | 12. 0 | 10. 5 | 36 | 33 | 4. 5 | 3. 7 | 78 | 70 | 27 | 23 | 33 | 30 |
| 2 – 6 anni | 12. 5 | 11. 5 | 37 | 34 | 4. 6 | 3. 9 | 81 | 75 | 27 | 24 | 34 | 31 |
| 6 – 12 anni | 13. 5 | 11. 5 | 40 | 35 | 4. 6 | 4. 0 | 86 | 77 | 29 | 25 | 34 | 31 |
| 2 – 18anni Femmine Maschi | ||||||||||||
| 14. 0 | 12. 0 | 41 | 36 | 4. 6 | 4. 1 | 90 | 78 | 30 | 25 | 34 | 31 | |
| 14. 5 | 13. 0 | 43 | 37 | 4. 9 | 4. 5 | 88 | 78 | 30 | 25 | 34 | 31 | |
| Adulti Femmine Maschi | ||||||||||||
| 14. 0 | 12. 0 | 41 | 36 | 4. 6 | 4. 0 | 90 | 80 | 30 | 26 | 34 | 31 | |
| 15. 5 | 13. 5 | 47 | 41 | 5. 2 | 4. 5 | 90 | 80 | 30 | 26 | 34 | 31 |
*Hb: emoglobina. Ht: ematocrito. GR: globuli rossi. MCV: volume corpuscolare medio. MCH: emoglobina eritrocitaria media. MCHC: concentrazione emoglobinica eritrocitaria media.
L’ANEMIA FERRO – CARENZIALE è una anemia ipocromica e microcitica. Nelle prime fasi l’ipocromia, ben evidente all’osservazione dello striscio di sangue periferico, prevale sulla microcitosi. (Fig. 4)
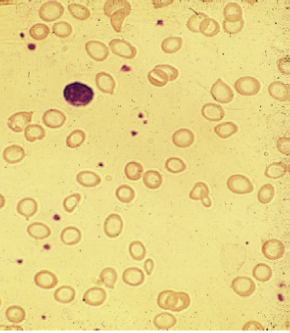
Fig. 4. Striscio di sangue periferico. Evidente ipocromia delle emazie
L’MCH è quindi il primo parametro a modificarsi. L’MCV si riduce successivamente mentre l’MCHC diminuisce nelle forme di lunga durata e più gravi. L’RDW, che misura l’anisocitosi delle emazie, è aumentato.
Hai bisogno di un parere su questa condizione?

Dott. Giovanni Schininà
30 minuti - 70 € 8 anni di esperienza Specialista in Ematologia Richiedi una televisita con: Dott. Giovanni SchininàGarantito in 24 ore! Con questo specialista o un suo collega.
I reticolociti sono moderatamente ridotti ma un valore di CHr (contenuto emoglobinico dei reticolociti) inferiore a 27,5 pg risulta modificato già nella fase di CARENZA MARZIALE. Una percentuale di cellule ipocromiche (emazie con concentrazione di Hb inferiore a 26-28 pg) superiore al 5-10% ed un rapporto tra cellule microcitiche (volume globulare < 60 fl) ed ipocromiche inferiore ad 1 sono indicativi di ANEMIA FERRO – CARENZIALE. (1-3,7,8)
È importante ricordare come anche il paziente con tratto thalassemico possa sviluppare una CARENZA MARZIALE. Data la prevalenza della thalassemia in Italia, soggetti con entrambe le patologie non sono rari ad osservarsi. Poiché queste condizioni vanno ad impattare nella stessa direzione sulla morfologia dei globuli rossi e sui parametri eritrocitari la loro contemporanea presenza può creare difficoltà interpretative dell’esame emocromocitometrico.
Inoltre, la CARENZA MARZIALE interferisce sulla sintesi delle δ-catene dell’HbA2 (riducendola): in sua presenza l’aumento della HbA2>3,5%, patognomonico del tratto β-thalassemico, può mancare e la diagnosi della thalassemia essere misconosciuta. In questi casi il trattamento della sideropenia risulta utile anche per “smascherare” la coesistenza del tratto thalassemico: risolta, infatti, la CARENZA MARZIALE la sintesi delle δ-catene non sarà più compromessa e l’eventuale β-thalassemia potrà essere evidenziata dall’aumento dell’HbA2 (1-3). È stato dimostrato, inoltre, come la CARENZA MARZIALE possa indurre un lieve aumento della sintesi di HbA1c, informazione da tener presente nel monitoraggio dei pazienti diabetici (12).
Una trombocitosi < 1. 000. 000 mmc non è infrequente. Nessuna alterazione significativa sui globuli bianchi; raramente si osserva una modesta riduzione dei neutrofili nelle ANEMIA FERRO – CARENZIALE di lunga durata. (1-3)
I parametri ematochimici di primo livello da utilizzare nell’iter diagnostico sono: la sideremia (modesta specificità, poiché diminuisce in corso di processi infettivi o flogistici acuti e cronici); la tranferrinemia (proteina di trasporto del ferro la cui sintesi aumenta se diminuiscono i depositi di ferro); l’indice saturazione della transferrina (IS) che valuta il rapporto tra sideremia e transferrinemia; la ferritinemia (correla con i depositi di ferro ma la sua concentrazione aumenta anche in corso di flogosi e nelle infezioni).
Tab. 3. Parametri ematologici e biochimici alterati nella ANEMIA FERRO – CARENZIALE (1-3,7,8)
| Riduzione dell’Hb, dei GR e dell’Ht < 2DS |
| Riduzione del MCV, del MCH e del MCHC < 2 DS |
| Aumento dell’RDW > 15% |
| Diminuzione del CHr <27-27,5 pg |
| Striscio di sangue periferico: emazie ipocromiche con tendenza alla microcitosi |
| Diminuzione della sideremia* <30mg/dl |
| Aumento della transferrinemia totale* (o espressa come TIBC) > 350 mg/dl |
| Diminuzione dell’indice di saturazione della transferrina <16%-20%* |
| Diminuzione della ferritinemia*: < 12-15 ng/ml. nei bambini (30-40ng/ml nei bambini in caso di PCR alterata), < 30 ng/ml nell’adulto e nella donna gravida, < 15 ng/ml nella donna fertile, <100 ng/ml negli adulti con processi infiammatori cronici, insufficienza renale, <200 ng/ml per i pazienti in dialisi E’ stato dimostrato che con un cut-off a 30ng/ml la sensibilità aumenta dal 25 al 92% La specificità rimane al 98% |
| ≠Aumento del recettore solubile della transferrina (sTfR) (VN 4-7 mg/l. Aumenta specificatamente (10-14 mg/l) nella carenza di ferro e la sua concentrazione non è influenzata da processi infiammatori e/o infettivi. (metodica disponibile al momento solo in alcuni laboratori) |
| *Esami da eseguire contemporaneamente e possibilmente associati a VES e PCR |
In seconda istanza potrebbe essere utile dosare la epcidina sierica. Questa è una proteina che svolge un ruolo chiave nel modulare l’assorbimento del ferro. Diminuisce nella CARENZA MARZIALE. Aumenta nei processi infiammatori. In questo caso si ha una riduzione dell’assorbimento ed un blocco del ferro nel sistema macrofagico. Il suo dosaggio risulta utile nella diagnosi differenziale tra CARENZA MARZIALE vera da quella funzionale legata a processi infiammatori/infettivi cronici. Risulta un parametro molto sensibile. Al momento disponibile solo in laboratori di ricerca per il costo elevato. La supplementazione con Vitamina D ridurrebbe la sintesi di epcidina favorendo l’assorbimento del ferro alimentare. (1-3,7,8,13)
È in fase di studio la valutazione del dosaggio sierico dell’eritroferrone, un ormone sintetizzato dagli eritroblasti che inibisce l’azione dell’epcidina aumentando la disponibilità di ferro per l’eritropoiesi. Al momento non è tuttavia ancora chiara la sua utilità nella diagnostica della CARENZA MARZIALE/ANEMIA FERRO – CARENZIALE rispetto ai più comuni ed economici test di laboratorio (13).
L’aspirato midollare e/o la biopsia ossea con l’esecuzione della colorazione di Perls o al blu di Prussia permette di valutare l’accumulo di ferro nell’interstizio e nei macrofagi midollari nonché la presenza di sideroblasti. In assenza di ferro colorabile si può porre diagnosi certa di ANEMIA FERRO – CARENZIALE anche senza altri test di laboratorio È ancora considerato il gold standard per la diagnosi di ANEMIA FERRO – CARENZIALE, altamente specifico e ampiamente sperimentato. Tuttavia, data la sua invasività, la necessità di personale esperto e l’alto costo da decenni non è più proposta routinariamente nella pratica clinica per la diagnostica della ANEMIA FERRO – CARENZIALE. (1-3,7,8,13)
L’iter Diagnostico della CARENZA MARZIALE/ANEMIA FERRO – CARENZIALE.
L’ANEMIA FERRO – CARENZIALE è la tappa finale di un processo di progressivo depauperamento del ferro dell’organismo come illustrato nella Fig. 3.

Fig. 5. Fasi dell’evoluzione della CARENZA MARZIALE verso l’ANEMIA FERRO – CARENZIALE
L’algoritmo della diagnostica della ANEMIA FERRO – CARENZIALE è riportato nella Fig. 6
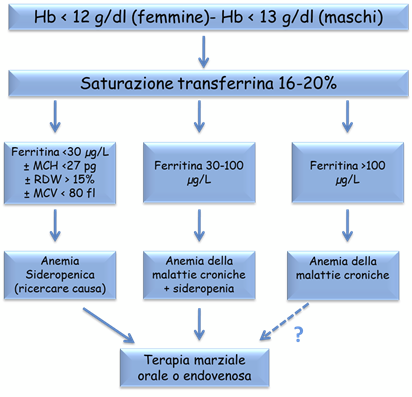
Fig. 6. Algoritmo nella diagnosi di ANEMIA FERRO – CARENZIALE
Deficit di acido folico e/o di Vitamina B12, che inducono una caratteristica macrocitosi delle emazie, possono coesistere con la ANEMIA FERRO – CARENZIALE in contesti di malassorbimento o malnutrizione. In tale evenienza l’MCV perde la valenza diagnostica per la ANEMIA FERRO – CARENZIALE.
In altre situazioni “confondenti”, quali la co-presenza della CARENZA MARZIALE con un tratto thalassemico, con patologie infiammatorie croniche o carenze di acido folico e/o Vitamina B12, i parametri di laboratorio possono non essere dirimenti. In questi casi se il sospetto di una CARENZA MARZIALE è fondato può essere preso in considerazione un breve trattamento con ferro per una diagnosi ex juvantibus (1-3).
Il Trattamento della CARENZA MARZIALE/ANEMIA FERRO – CARENZIALE
<< Ferrum bonum et laudabile>> Il trattamento si basa su tre cardini:
1) identificazione e rimozione delle cause della sideropenia;
2) somministrazione di preparati di ferro medicamentoso per via orale (1-3 mesi) o raramente per via endovenosa per normalizzare i livelli di emoglobina e gli altri parametri ematologici;
3) prolungare la terapia anche dopo la normalizzazione dell’emoglobina per ricostituire le scorte (in genere 2-3 mesi). La terapia marziale va iniziata già nella fase pre-anemica (qualora intercettata) per contrastare gli effetti sistemici della CARENZA MARZIALE e per evitare la progressione verso l’anemia. (1-3,7,8). (Fig. 3)
L’anamnesi deve essere mirata a ricercare quelle condizioni che possono sottendere ad un depauperamento marziale. La mancata rimozione conduce spesso ad un insuccesso del trattamento (forme resistenti).
Qualora la causa sia da ascrivere ad una dieta incongrua povera di ferro e i livelli di emoglobina siano solo moderatamente ridotti, un riequilibrio rigoroso dell’alimentazione può essere sufficiente a correggere il quadro ematologico (1-3).
L’obiettivo del trattamento farmacologico è quello di fornire un quantitativo di ferro adeguato a normalizzare i livelli di emoglobina e per ricostituire le scorte di ferro (ferro di deposito). La somministrazione orale di ferro rappresenta la modalità di prima scelta. Il ferro può essere somministrato sotto forma di sale ferroso (Fe++) o ferrico (Fe+++).
Analogamente al ferro non-emico della dieta, quello medicamentoso è assorbito in forma bivalente soprattutto a livello duodenale. I preparati trivalenti devono essere ridotti a bivalenti ad opera della ferroriduttasi presente sulla superfice delle cellule intestinali; nel processo si ha una perdita importante della quota assorbita.
L’assorbimento non supera il 10-35% della dose somministrata e varia in base al tipo di sale (quelli ferrosi sono assorbiti meglio dei ferrici), alla presenza di cibo nello stomaco (a digiuno il ferro è assorbito il 20-30% in più ma è meglio tollerato) ed al grado di anemia (più è marcata maggiore è l’assorbimento). (1-3,7,8,14,15)
Il solfato ferroso, a distanza di quasi due secoli dalle osservazioni di Pierre Blaud (1832) che trattò le sue pazienti affette da clorosi, per la prima volta e con buoni risultati, con questo composto (pillole di Blaud), rimane il composto di riferimento. In un testo di inizio ‘ 900 il medico berlinese Grawiz confermava come la <<cura ferruginosa>> fosse essenziale nel trattamento della clorosi. Lo stesso autore confermava anche l’efficacia delle pillole di Blaud, sottolineando tuttavia come già al tempo fosse straordinariamente ricco l’assortimento di preparati di ferro organico (solfato, carbonato, cloruro, sesquicloruro), o combinato in forma albuminato (anche in versione liquorosa), o in formulazioni contenenti emoglobina oltre che in << acque ferruginose>>. Negli anni ‘ 20-’ 30 venivano commercializzate altre formulazioni del tutto particolari come illustrato in alcune pubblicità d’ epoca
Attualmente il solfato ferroso oltre ad essere il più prescritto è anche il meno costoso in commercio. Ha tuttavia una scarsa tollerabilità gastroenterica (epigastralgia, nausea, vomito, dolori addominali, stipsi o diarrea) che spesso impedisce l’aderenza alla prescrizione. Per limitare gli effetti indesiderati del ferro ad uso terapeutico sono state commercializzate altre formulazioni di Fe++ quali il fumarato, il gluconato, il pidolato, la ferroglicina, il bisglicinato chelato e più recentemente il bisglicinato chelato alginato (Feralgina®), o di Fe+++ quali il ferro saccarato, il ferromaltoso, il ferro sodico EDTA ed il sucrosomiale o liposomiale).
Hai bisogno di un parere su questa condizione?

Dott.ssa Santina Basile
30 minuti - 65 € 13 anni di esperienza Specialista in Ematologia Richiedi una televisita con: Dott.ssa Santina BasileGarantito in 24 ore! Con questo specialista o un suo collega.
Nel bambino il dosaggio consigliato è di 2-6 mg/kg/die di ferro elementare in 1- 2- (3) somministrazioni. Negli adolescenti e nell’adulto la dose varia da 60 a 200 mg/die di ferro elementare in 1-3 somministrazioni (1-3,7,8,14,15). Per quanto riguarda il ferro chelato bisglicinato (e quello alginato) sono sufficienti dosi pari a circa il 25%-50% rispetto al solfato ferroso (16). Un’attenzione particolare va posta nel trattamento nei soggetti anziani che mostrano spesso minor assorbimento e più frequenti effetti collaterali. (17)
È consigliabile iniziare la terapia a dosaggio ridotto (eventualmente ai pasti) per testarne la tollerabilità, preferibilmente con un Fe++. (1-3) La dose va aumentata gradualmente fino a raggiungere nel giro di 1-2 settimane il dosaggio massimo, da somministrare a stomaco vuoto se tollerato. Recenti dati suggerirebbero come l’associazione dei sali ferrosi con probiotici quali il Lactobacillus plantarum 299v o il Lactobacillus fermentum migliorerebbe l’assorbimento ma i risultati non sono univoci. (18-20)
È stato dimostrato come una singola dose di ferro aumenti la sintesi di epcidina per almeno 24h e saturi per lo stesso periodo di tempo la capacità funzionale della DMT-1 intestinale. Conseguentemente l’assorbimento del ferro subisce un importante decremento durante questo lasso di tempo. Studi clinici hanno evidenziato come somministrando la stessa dose a giorni alterni, durante un ciclo terapeutico l’assorbimento della quantità totale di ferro risultasse sovrapponibile a quella ottenuta con la somministrazione giornaliera, ma con minori effetti indesiderati e minori costi (21)
Dal punto di vista clinico, già dopo le prime giornate di terapia si può osservare un miglioramento della cenestesi come effetto della riattivazione di circuiti enzimatici endocellulari contenenti ferro. La risposta ematologica è documentabile precocemente da un aumento della conta reticolocitaria e del CHr (48-96 ore dopo l’inizio della terapia). Per osservare un incremento di emoglobina di circa un grammo è necessario attendere almeno due-quattro settimane di trattamento (1-3). Nella pratica, soprattutto in età pediatrica, per non sottoporre i pazienti a prelievi ematici ravvicinati, in genere non si eseguono controlli prima di un mese di terapia. Ottenuta la normalizzazione dei parametri ematologici ed ematochimici la somministrazione di ferro deve essere prolungata per almeno altri 2-3 mesi per ripristinare i depositi. (1-3,7,8)
In ragione della durata del trattamento e dei possibili effetti collaterali, la piena aderenza alla prescrizione può essere difficile da ottenere. Il medico avendo a disposizione numerose preparazioni di ferro può individuare quella migliore per ciascun paziente (il <<tailored treatment>> degli autori anglosassoni).
La mancata risposta alla terapia (ANEMIA FERRO – CARENZIALE resistente) impone una attenta rivalutazione della prescrizione (tipo di ferro somministrato e dose giornaliera) nonché delle dosi realmente assunte dal paziente. Data l’alta prevalenza della MC nella nostra popolazione (1 su 100-150 soggetti adulti) occorre indirizzare le indagini anche in questa direzione. (22,23) Alcune istituzioni, soprattutto in ambito pediatrico, propongono di valutare l’eventuale presenza della celiachia già in prima battuta al momento della diagnosi di ANEMIA FERRO – CARENZIALE in modo da evitare il rischio di un trattamento di prima linea inefficace. Potrebbe essere utile eseguire un test da carico di ferro per valutare l’assorbimento del preparato prescritto. (24)
In casi selezionati si può ricorrere alla somministrazione di preparati di ferro parenterale. Praticamente abbandonata la via intramuscolare si ricorre qualora necessario alla via endovenosa (EV). La somministrazione EV di complessi di ferro può associarsi ad effetti collaterali quali rash, palpitazioni, tremori, mialgie, dolori toracici, ipotensione e sintomi respiratori (1 su 200 somministrazioni). La sintomatologia si risolve in genere interrompendo l’infusione.
Reazioni anafilattiche gravi (shock anafilattico) sono rarissime ed in alcuni casi sono risultate fatali. In genere le reazioni si verificano con la prima dose, durante l’infusione o entro 5 minuti dal termine. Le raccomandazioni dell’AIFA del 2013 (https://www. aifa. gov. it/-/nota-informativa-importante-su-medicinali-contenenti-ferro-25-10-2013) e ribadite nel 2021, ricordano come << Tutti i medicinali contenenti ferro per via IV possono causare gravi reazioni da ipersensibilità potenzialmente fatali>> e stabiliscono che <<I medicinali contenenti ferro per via IV devono essere somministrati solo quando sia immediatamente disponibile personale qualificato, in grado di valutare e gestire reazioni anafilattiche/anafilattoidi, e apparecchiature di rianimazione>>
Questa modalità è indicata, quindi, in prima istanza solo per pazienti selezionati quali soggetti con gravi patologie gastroenterologiche, con insufficienza renale cronica, con malattie infiammatorie croniche, con miocardiopatie croniche scompensate, con anemia grave instabile (Hb <6-7 gr/dl), che rifiutino la trasfusione di emazie per motivi religiosi, in caso di autodonazione di sangue per interventi chirurgici. (1-3,7,8,25,26) La terapia EV può essere considerata nei pazienti con intolleranza assoluta ai preparati per os.
Il prodotto al momento più utilizzato in Italia è il ferro gluconato (Ferlixit®), che ha un rischio di reazioni anafilattiche pari allo 0,04%. Non è consigliato per i bambini al di sotto dei tre anni per la presenza di alcol benzilico. Il ferro saccarato (Venofer® o Fermed®) presenta minor rischio di reazioni anafilattiche (0,002% dei casi), ma è più costoso; è indicato anche per i bambini e lattanti. È disponibile anche il carbosimaltosio ferrico (Ferrinject®) somministrabile ad intervalli più lunghi rispetto agli altri preparati. Più recentemente sono stati commercializzati anche il ferro isomaltoso (Monofer®) ed il ferumoxytol (Rienso®). Questi ultimi tre prodotti sono indicati solo per soggetti adulti. Altri prodotti sono in fase avanzata di studio o commercializzati in altri Paesi.
La quantità totale di ferro e. v. da somministrare può essere calcolata in base a formule matematiche che tengono conto del peso, della volemia, del deficit di emoglobina e del rapporto tra Hb e ferro (un grammo di Hb lega 3,4 mg di ferro).
La terapia con Ferrinject®, ha trovato recentemente indicazione elettiva nei pazienti con miocardiopatia cronica scompensata con significativi miglioramenti dei parametri clinici e strumentali (26). La sua somministrazione può essere suggerita in gravidanza (27) e negli anziani (17).
L’ANEMIA FERRO – CARENZIALE anche se di grado severo non costituisce di per sé un’indicazione alla terapia trasfusionale salvo nei pazienti emodinamicamente instabili in cui livelli di emoglobina (<7-8gr/dl) si associno a compromissione delle funzioni cardiocircolatorie. (1-3,7,8).
Prevenzione della CARENZA MARZIALE/ANEMIA FERRO – CARENZIALE
Secondo l’American Academy of Pediatrics, in considerazione degli stretti rapporti tra CARENZA MARZIALE/ANEMIA FERRO – CARENZIALE e sviluppo neurocognitivo, suscettibilità alle infezioni e rallentamento della crescita, la loro prevenzione nella prima infanzia rappresenta un importante tema di salute pubblica meritevole di uno screening universale tra i 12 e 18 mesi. (28) Un monitoraggio è anche consigliato nelle adolescenti dopo il menarca e nei maschi durante lo spurt puberale tenuto conto della alta prevalenza della CARENZA MARZIALE/ANEMIA FERRO – CARENZIALE in questa fascia di età. (29) Analogamente vanno monitorati gli adolescenti e gli adulti che praticano attività sportiva. (30)
I neonati prematuri seguono abitualmente protocolli di prevenzione fin dalle prime settimane di vita con la somministrazione di ferro orale (2,3). Una profilassi è fortemente raccomandata anche durante la gravidanza e l’allattamento per garantire un adeguato supporto di ferro alla madre, al feto ed al neonato (2,3). Altri soggetti quali gli adolescenti (soprattutto femmine), le donne con disturbi mestruali, i donatori di sangue, i soggetti che assumono aspirina ed i maratoneti sono candidati ad una profilassi intermittente.
Alcuni autori suggeriscono la somministrazione di ferro durante il ciclo mestruale quando l’assorbimento del ferro è aumentato per lo stimolo eritropietico indotto dalle perdite ematiche. In molti paesi in via di sviluppo sono attivati piani di prevenzione arricchendo con ferro cibi di largo consumo, quali i cereali.
Qualunque supplementazione marziale di lunga durata deve essere sempre monitorata dal medico onde evitare che un eccesso di ferro non necessario possa causare alterazioni degli enterociti e del microbiota intestinale, o un sovraccarico tissutale.
Le conclusioni
La CARENZA MARZIALE e la ANEMIA FERRO – CARENZIALE rappresentano dalle condizioni relativamente frequenti che impattano sulla qualità di vita del paziente. In considerazione della valenza sistemica della CARENZA MARZIALE/ANEMIA FERRO – CARENZIALE appare quindi suggestivo evocare il concetto di <<malattia sideropenica>> come proposto alcuni anni or sono dal medico cileno Tomas Walter.
Hai bisogno di un parere su questa condizione?

Dott. Giovanni Schininà
30 minuti - 70 € 8 anni di esperienza Specialista in Ematologia Richiedi una televisita con: Dott. Giovanni SchininàGarantito in 24 ore! Con questo specialista o un suo collega.
La diagnostica si basa sulla valutazione di parametri ematologici e biochimici ed é, in genere, relativamente facile. Nel bambino il trattamento è importante per garantire un normale accrescimento staturo-ponderale e per evitare i danni cognitivo-comportamentali; nell’adulto per migliorare la performance psico-fisica e per migliorare la qualità di vita.
La terapia, tuttavia, può presentare delle criticità. I possibili effetti indesiderati e la durata possono, infatti, porre problematiche di aderenza alla prescrizione. Al medico compete, oltre ad una ricerca esaustiva delle cause e del miglior trattamento per il singolo paziente, anche l’impegno in una efficace comunicazione per ottenere una adeguata compliance ed evitare terapie inefficaci; al paziente compete di seguire con scrupolosità le prescrizioni farmacologiche e dietetiche del curante.
Roberto Miniero1
Laura Giancotti2
Maria Concetta Galati3
Giuseppe Raiola1
Paola Saracco4
Alessandro Busca5
Giuseppe Antonio Mazza6
Valentina Talarico1
1 Dipartimento Materno Infantile, Azienda Ospedaliera “Pugliese-Ciaccio” di Catanzaro
2 Centro di riferimento regionale per la diagnosi ed il follow-up della malattia celiaca, S. O. C. Pediatria/Università Magna Graecia di Catanzaro
3 S. O. C di Oncoematologia Pediatrica, Azienda Ospedaliera “Pugliese-Ciaccio” di Catanzaro
4 S. O. C. di Ematologia Pediatrica, Città della Salute e della Scienza. Torino.
5 Centro Trapianti di Midollo Osseo, Città della salute e della Scienza. Torino.
6 S. O. C. di Cardiologia Pediatrica, Città della Salute e della Scienza. Torino.
Hai bisogno di un parere su questa condizione?

Dott. Giovanni Schininà
30 minuti - 70 € 8 anni di esperienza Specialista in Ematologia Richiedi una televisita con: Dott. Giovanni SchininàGarantito in 24 ore! Con questo specialista o un suo collega.
Bibliografia

Categorie
- Allergie e intolleranze
- Apparato Urogenitale
- Autismo e Disturbi dello Spettro Autistico
- Benessere Psichico e Salute mentale
- Caduta dei Capelli
- Coronavirus
- Disfunzioni della Tiroide
- Disturbi Alimentari
- Disturbi del Sonno
- Disturbi Gastrointestinali
- Epidemie e pandemie
- Farmaci - Terapie - effetti collaterali
- Malattie Autoimmuni
- Malattie infettive
- Malattie Infiammatorie
- Malattie Respiratorie
- Malattie Reumatiche
- News
- Patologie Cardiovascolari
- Patologie del Piede
- Patologie del Sangue e della Coagulazione
- Patologie del Sistema Nervoso
- Patologie della Pelle
- Patologie Oculari
- Prevenzione e salute
- Problemi Muscoloscheletrici
- Salute dei Bambini
- Salute dell'Anziano
- Salute della Donna
- Telemedicina
- Terapie e Rimedi Naturali
- Terapie Oncologiche
- Viaggi e Salute
- Video
- Vivere con il Diabete


 ggg
ggg